Νέα έρευνα εξετάζει τους παράγοντες που επιταχύνουν και επιβραδύνουν τις εκτιμήσεις από τις Επιτροπές Αξιολόγησης και Αποζημίωσης Φαρμάκων- HTA για σκευάσματα σπάνιων ασθενειών σε ολόκληρη την Ευρώπη.
Τα φάρμακα για τις σπάνιες ασθένειες αντιμετώπιζαν πάντα προκλήσεις όσον αφορά τις εγκρίσεις από τον HTA, ακόμη και όταν οι κυβερνήσεις προωθούσαν περισσότερες κανονιστικές πολιτικές για να διευκολύνουν την εκτίμηση τους.
Αρκετοί παράγοντες καθιστούν δύσκολο για τους οργανισμούς HTA να εκτιμούν συχνά ορφανά φάρμακα, συμπεριλαμβανομένης της έλλειψης ισχυρών δεδομένων δοκιμών λόγω δυσκολιών στην εύρεση ασθενών, της απουσίας τυχαιοποιημένων ελεγχόμενων δοκιμών, της χρήσης υποκατάστατων και της έλλειψης ενεργών συγκριτικών φαρμάκων.
Μια νέα ανάλυση από την εταιρεία συμβούλων CRA έχει επικεντρωθεί στις διάφορες προκλήσεις που αντιμετωπίζουν τα σκευάσματα για σπάνιες παθήσεις σε τέσσερις ευρωπαϊκές αγορές - Αγγλία, Γαλλία, Γερμανία και Σκωτία - και εξέτασε πώς οι φαρμακοβιομηχανίες μπορούν να αυξήσουν τις πιθανότητες της επιτυχούς αξιολόγησης τους.
Η έρευνα ανέλυσε περισσότερες από 70 θεραπείες σπάνιων νόσων που έχουν εγκριθεί από τον EMA και συνέκρινε τις συστάσεις αποζημίωσης από τους ρυθμιστικούς φορείς σε κάθε χώρα.
Τα αποτελέσματα δείχνουν ότι οι HTA για ορφανά φάρμακα μπορεί να ποικίλλουν ευρέως σε ολόκληρη την Ευρώπη, προκαλώντας ασυνέπειες στις απαιτήσεις και στις συστάσεις επιπλέον αποδεικτικών στοιχείων από τις εταιρείες.
Ποσοστά έγκρισης
Η μελέτη εξέτασε και τα 80 φάρμακα που εγκρίθηκαν από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) που έλαβαν χαρακτηρισμό ως ορφανά, μεταξύ της 1ης Ιανουαρίου 2013 και της 31ης Δεκεμβρίου 2019, αναλύοντας τα αποτελέσματα και τον χρόνο αποζημίωσης σε Γαλλία, Γερμανία, Αγγλία και Σκωτία.
Στη συνέχεια πραγματοποιήθηκε συγκριτική ανάλυση για τα 71 εγκεκριμένα φάρμακα που πέτυχαν διαπραγματευτική τιμή τουλάχιστον σε μία από τις τέσσερις αγορές.
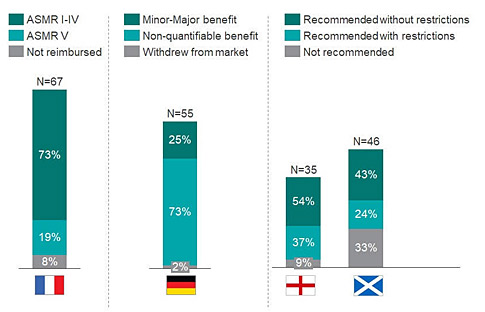
Η Γερμανία είχε το υψηλότερο ποσοστό έγκρισης ορφανών φαρμάκων, στο 98%. Ωστόσο, οι περισσότερες από αυτές τις συστάσεις (73%) έχουν λάβει διαβάθμιση πιστοληπτικής ικανότητας «μη μετρήσιμα οφέλη», το οποίο δείχνει η ρυθμιστική αρχή δεν βλέπει κανένα όφελος σε σχέση με τα προϊόντα σύγκρισης (βλέπε γράφημα 1).
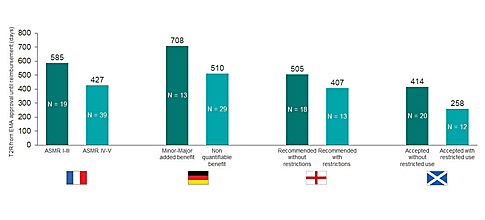
Ένα ευνοϊκότερο αποτέλεσμα από τη γερμανική ρυθμιστική αρχή χρειάστηκε κατά μέσον όρο 1,4 φορές περισσότερο χρόνο για να επιτευχθεί μια τελική τιμή διαπραγμάτευσης (708 έναντι 510 ημερών).
Η Γαλλία και η Αγγλία είχαν συγκρίσιμα ποσοστά έγκρισης (92% και 91%, αντίστοιχα). Ωστόσο, η Γαλλία εξέτασε σχεδόν το διπλάσιο του αριθμού των ορφανών φαρμάκων κατά την περίοδο της ανάλυσης (67 έναντι 35). Ωστόσο, το 19% των ορφανών σκευασμάτων στη Γαλλία έλαβε βαθμολογία V Amelioration du Service Médical Rendu (ASMR) ότι παρέχουν δηλαδή βελτιωμένο ιατρικό όφελος. Τα φάρμακα με βαθμολογία ASMR IV-V αποζημιώθηκαν σε 427 ημέρες, σε σύγκριση με 585 ημέρες για προϊόντα με ASMR I-III (γράφημα 2).
Στην Αγγλία, δύο βασικοί μηχανισμοί χρησιμοποιήθηκαν συχνά για την επίτευξη έγκρισης: περιορισμοί ετικετών ή σχέδιο πρόσβασης ασθενούς (PAS).
Πάνω από το ένα τρίτο (37%) των ορφανών φαρμάκων που αξιολογήθηκαν από τη NICE πέτυχαν έγκριση μόνο σε μια θέση ή πληθυσμό που ήταν περιορισμένος έναντι της πλήρους εγκεκριμένης κανονιστικής ετικέτας.Οι εταιρείες που αποδέχτηκαν αυτούς τους περιορισμούς είδαν ταχύτερο χρόνο έγκρισης σε σύγκριση τα φάρμακα που δεν δέχτηκαν τέτοιους περιορισμούς (407 έναντι 505 ημέρες).
Η Σκωτία είχε το υψηλότερο ποσοστό μη έγκρισης για ορφανά φάρμακα. Τριάντα τρία τοις εκατό των φαρμάκων που εξετάστηκαν δεν έγιναν δεκτά, παρά τις τροποποιήσεις και της συμμετοχής της Ενωσης Ασθενών με σπάνιες παθήσεις κατά την υποβολή των σχετικών φακέλων.Σημειώνεται ότι η 'Ενωση Ασθενών συμμετείχε στο 74% των υποβολών ορφανών φαρμάκων. μεταξύ 2013-2019.
Βελτίωση των αποτελεσμάτων HTA
Οι συγγραφείς καταλήγουν στο συμπέρασμα ότι, ενώ οι διάφορες παραχωρήσεις και τροποποιήσεις που εισήγαγαν διαφορετικές κυβερνήσεις έχουν θετικό αντίκτυπο στην ελαχιστοποίηση των απορρίψεων και την επιτάχυνση των χρόνων έγκρισης, εξακολουθούν να υπάρχουν προκλήσεις για την καταγραφή της πλήρους αξίας των ορφανών φαρμάκων στη διαδικασία HTA.
Οι συγγραφείς περιγράφουν διάφορες προσεγγίσεις που μπορούν να ακολουθήσουν οι εταιρείες για να βελτιώσουν τις πιθανότητες επιτυχίας στις εγκρίσεις ορφανών φαρμάκων, ξεπερνώντας την πρόκληση να έχουν περιορισμένα δεδομένα και αποδεικτικά στοιχεία.
Μια προσέγγιση είναι να συμφωνηθούν μέθοδοι για τη συνεχή συλλογή δεδομένων στον πραγματικό κόσμο.
Προσθέτουν ότι οι «δημιουργικές» λύσεις για τη συλλογή αποδεικτικών στοιχείων πραγματικού κόσμου θα μπορούσαν να βοηθήσουν, όπως η ανάπτυξη εφαρμογών για ασθενείς και HCP.
Επίσης, η ακρόαση απόψεων από ασθενείς αλλά και οι πιο έμμεσες μορφές εμπλοκής των ενδιαφερομένων μπορεί επίσης να βελτιώσουν τα αποτελέσματα της HTA, καθώς οι υπηρεσίες προστιθέμενης αξίας που παρέχονται σε αυτούς τους ενδιαφερόμενους μπορούν να αξιοποιηθούν κατά τη διάρκεια των διαπραγματεύσεων.
Πηγές:
pharmaphorum
Ειδήσεις υγείας σήμερα
Επίσκεψη Γεωργιάδη στο "Βοστάνειο" Μυτιλήνης και στο Κέντρo Υγείας Μανταμάδου
Ποια ψάρια έχουν τα μεγαλύτερα οφέλη για την καρδιά και τον εγκέφαλο
Εντοπίστηκε νέος ιός που συνδέεται με τον καρκίνο στο παχύ έντερο

 Επίσκεψη Γεωργιάδη στο "Βοστάνειο" Μυτιλήνης και στο Κέντρo Υγείας Μανταμάδου
Επίσκεψη Γεωργιάδη στο "Βοστάνειο" Μυτιλήνης και στο Κέντρo Υγείας Μανταμάδου Επιστολή ΙΣΑ στον υπουργό Υγείας για τον αποκλεισμό εξειδικευόμενων ιατρών από άσκηση ιδιωτικού έργου
Επιστολή ΙΣΑ στον υπουργό Υγείας για τον αποκλεισμό εξειδικευόμενων ιατρών από άσκηση ιδιωτικού έργου 'Οταν η προσφορά γίνεται ζωή: Δύο διαδικασίες δωρεάς οργάνων στο ΑΧΕΠΑ
'Οταν η προσφορά γίνεται ζωή: Δύο διαδικασίες δωρεάς οργάνων στο ΑΧΕΠΑ Ξεκίνησε η διαδικασία πρόσληψης νέου εκτελεστικού διευθυντή στον ΕΜΑ
Ξεκίνησε η διαδικασία πρόσληψης νέου εκτελεστικού διευθυντή στον ΕΜΑ 'Εφυγε από τη ζωή σε ηλικία 53 ετών ο ηθοποιός Έρικ Ντέιν - Eίχε διαγνωστεί με ALS
'Εφυγε από τη ζωή σε ηλικία 53 ετών ο ηθοποιός Έρικ Ντέιν - Eίχε διαγνωστεί με ALS Μεταξύ 50 και 91 εκατ. ευρώ το συνολικό ετήσιο κόστος της νωτιαίας μυϊκής ατροφίας στην Ελλάδα
Μεταξύ 50 και 91 εκατ. ευρώ το συνολικό ετήσιο κόστος της νωτιαίας μυϊκής ατροφίας στην Ελλάδα Ποια ψάρια έχουν τα μεγαλύτερα οφέλη για την καρδιά και τον εγκέφαλο
Ποια ψάρια έχουν τα μεγαλύτερα οφέλη για την καρδιά και τον εγκέφαλο ECDC: Σε ύφεση οι ιώσεις του αναπνευστικού - Τι γίνεται στην Ελλάδα
ECDC: Σε ύφεση οι ιώσεις του αναπνευστικού - Τι γίνεται στην Ελλάδα Αναπνευστικός συγκυτιακός ιός - RSV: Τι πρέπει να γνωρίζουν οι γονείς
Αναπνευστικός συγκυτιακός ιός - RSV: Τι πρέπει να γνωρίζουν οι γονείς Εντοπίστηκε νέος ιός που συνδέεται με τον καρκίνο στο παχύ έντερο
Εντοπίστηκε νέος ιός που συνδέεται με τον καρκίνο στο παχύ έντερο Εγκεφαλικό επεισόδιο: Σημαντική δευτερογενής πρόληψη με νέα θεραπεία
Εγκεφαλικό επεισόδιο: Σημαντική δευτερογενής πρόληψη με νέα θεραπεία Γεωργιάδης: Ιατρικό λάθος ο θάνατος του μοντέρ Κώστα Κοσμίδη στο Κέντρο Υγείας Σαλαμίνας
Γεωργιάδης: Ιατρικό λάθος ο θάνατος του μοντέρ Κώστα Κοσμίδη στο Κέντρο Υγείας Σαλαμίνας Εξαγορά της Δυναμικής Φαρμακαποθήκης από την Profarm
Εξαγορά της Δυναμικής Φαρμακαποθήκης από την Profarm 'Aνοια: Ποιες παθήσεις αυξάνουν τον κίνδυνο [μελέτη]
'Aνοια: Ποιες παθήσεις αυξάνουν τον κίνδυνο [μελέτη] Ποια άσκηση του εγκεφάλου ενδεχομένως προστατεύει από την άνοια 20 χρόνια [μελέτη]
Ποια άσκηση του εγκεφάλου ενδεχομένως προστατεύει από την άνοια 20 χρόνια [μελέτη] Οι 10 πιο αναμενόμενες κυκλοφορίες φαρμάκων για το 2026
Οι 10 πιο αναμενόμενες κυκλοφορίες φαρμάκων για το 2026 Γρίπη: 67% περισσότεροι θάνατοι φέτος - Τι άλλαξε - Οι διαφορές με τον RSV [πίνακες]
Γρίπη: 67% περισσότεροι θάνατοι φέτος - Τι άλλαξε - Οι διαφορές με τον RSV [πίνακες] Πανεπιστημιακά Κέντρα Υγείας: Μία ευκαιρία που δεν πρέπει να πάει χαμένη
Πανεπιστημιακά Κέντρα Υγείας: Μία ευκαιρία που δεν πρέπει να πάει χαμένη