H εξατομικευμένη φροντίδα υγείας και ειδικότερα οι γονιδιακές θεραπείες, ήταν το θέμα που ανέπτυξε ο κ. Χρήστος Δάκας, Διευθύνων Σύμβουλος, Novartis Gene Therapies, στο συνέδριο του Iatronet.gr, 5th Healthcare Transformation Connecting Ecosystems.
Συγκεκριμένα, για τα προβλήματα που αντιμετωπίζουν οι κυτταρικές και γονιδιακές θεραπείες όσον αφορά την αποζημίωση αλλά κυρίως την πρόσβαση των ασθενών σε αυτές τις θεραπείες.
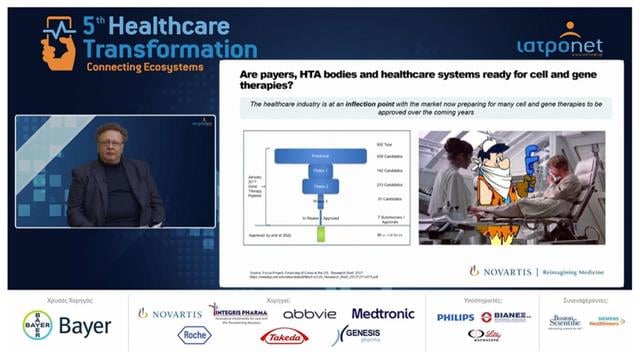
Το κύριο ερώτημα που πρέπει να απαντηθεί είναι εάν οι Οργανισμοί αποζημίωσης , τα όργανα ΗΤΑ και τα συστήματα υγείας γενικά είναι έτοιμα να δεχθούν τις κυτταρικές και γονιδιακές θεραπείες.
Αυτή τη στιγμή η φαρμακοβιομηχανία βρίσκεται σε ένα σημείο καμπής διότι έρχονται 932 κυτταρικές και γονιδιακές θεραπείες τα επόμενα χρόνια. Και μιλάμε για θεραπείες, οι οποίες είναι εξατομικευμένες, εκ των οποίων πολλές από αυτές για σπάνια νοσήματα κληρονομικά και άλλες για σπάνιες μορφές καρκίνου. Αρα, το προαναφερθέν ερώτημα κατά πόσο είναι έτοιμα τα συστήματα υγείας για αυτές τις θεραπείες και επίσης να υπάρχει πρόσβαση του ασθενή, είναι καίριο.
Θα μιλήσουμε λοιπόν για το περιβάλλον, τις προκλήσεις που υπάρχουν στην αποζημίωση από τους φορείς, για τα μοντέλα αποζημίωσης καθώς και για τις αλλαγές που πρέπει να γίνουν, έτσι ώστε οι ασθενείς να έχουν πρόσβαση.
Οσον αφορά το περιβάλλον, σύμφωνα με τον κ. Χ. Δάκα, πρέπει να δούμε τι σηματοδοτούν οι γονιδιακές και κυτταρικές θεραπείες που ουσιαστικά είναι η άφιξη μιας νέας εποχής στην ιατρική. Και κάνει μια σύγκριση των συμβατικών και των γονιδιακών θεραπειών, καθώς πάνω σε αυτές υπάρχουν τα προβλήματα στην αξιολόγηση, την αποζημίωση και την πρόσβαση.
Οταν λοιπόν μιλάμε για μία συμβατική θεραπεία, για τη χορήγησή της, αυτή είναι επαναλαμβανόμενη και συνήθως γίνεται χρόνια, ενώ μία γονιδιακή θεραπεία δίνεται μόνο μία φορά, εφάπαξ, δεν γίνεται χρόνια και σπανίως να υπάρχουν κάποια βραχυχρόνια σχήματα, δηλαδή και μία δεύτερη και τρίτη δόση. Αλλά συνήθως οι περισσότερες κυτταρικές και γονιδιακές θεραπείες είναι για μία φορά. Το δεύτερο είναι ο μηχανισμός δράσης. Στις συμβατικές θεραπείες, ο στόχος είναι η εξάλειψη των συμπτωμάτων και δεν κοιτά να λύσει τα βασικά αίτια της νόσου. Από την άλλη, στη γονιδιακή και κυτταρική θεραπεία χτυπάμε το αίτιο της νόσου και συνήθως έχουμε δύο αποτελέσματα -ή σταματά την εξέλιξη της νόσου, ή θα προσφέρει μια πραγματική θεραπεία και θα απαλλαγούμε από τη νόσο. Όσον αφορά τη διάρκεια, οι συμβατικές θεραπείες είναι συνήθως χρόνιες, ενώ εδώ μιλάμε για μία εφάπαξ χορήγηση με πολλαπλά οφέλη. Επίσης όσον αφορά την πρόσβαση, τα συστήματα είναι προσαρμοσμένα στο να μπορούν να αξιολογούν και να εκτιμούν στο τι προσφέρουν οι χρόνιες θεραπείες και όχι να εκτιμούν το μακροπρόθεσμο όφελος που έχει μια κυτταρική-γονιδιακή θεραπεία.
Τέλος, τα μοντέλα αποζημίωσης είναι σχεδιασμένα για τη μακροχρόνια χορήγηση, ενώ η μία και μοναδική δόση που αντιπροσωπεύουν σταθερά οι γονιδιακές θεραπείες, καθώς και το αρχικό υψηλό κόστος που είναι εμπροσθοβαρές είναι πραγματικά μια μεγάλη πρόκληση για τα συστήματα αποζημίωσης.
Υπάρχει μια σειρά γονιδιακών θεραπειών που ξεκίνησαν το 2012 ενώ εγκρίθηκαν αρκετές από τον ΕΜΑ τα τρία τελευταία χρόνια. Το πρόβλημα είναι ότι αυτές οι θεραπείες δεν είναι πάντοτε γνωστές γιατί απευθύνονται σε σπάνιες νόσους ή σε νοσήματα που δεν είναι ευρέως γνωστά, αλλά ταυτόχρονα πολλές από αυτές δεν έχουν στεφθεί από επιτυχία λόγω των προβλημάτων που αντιμετώπισαν στην αποζημίωση. Ενα τέτοιο παράδειγμα είναι το Ζynteglo, το οποίο εγκρίθηκε το 2019 της Βluebird bio, η οποία μετά τις προκλήσεις που αντιμετώπισε στην Ευρώπη, αυτό που αποφάσισε ήταν να αποχωρήσει από την Ευρώπη γενικώς. Ετσι αυτή η θεραπεία που θα ήταν πολύ σημαντική και για την Ελλάδα καθώς αφορά την μεσογειακή αναιμία είναι διαθέσιμη μόνο στην Αμερική.
Αρα οι θεραπείες που χορηγούνται μόνο μία φορά και προσφέρουν μεγάλες αλλαγές στη βελτίωση με βάση τα πρότυπα φροντίδας οδηγούν σε σημαντική αλλαγή του τρόπου που πρέπει οι οργανισμοί αποζημίωσης να σκεφτούν τον τρόπο τιμολόγησής τους και τους τρόπους πληρωμής για τέτοιου είδους θεραπείες.
Το οξύμωρο που συμβαίνει είναι ότι εξελίξεις που υπάρχουν στα κανονιστικά μονοπάτια της έγκρισης μιας κυτταρικής και γονιδιακής θεραπείας δεν συμβαδίζουν με τα δρώμενα στις επιτροπές αξιολόγησης και αποζημίωσης. Ετσι, ενώ οι ρυθμιστικοί μηχανισμοί του εξωτερικού εγκρίνουν τις θεραπείες αυτό δεν το βλέπουμε να ισχύει και με τις άνωθεν επιτροπές.
Στη συνέχεια της ομιλίας του αναφέρθηκε στις προκλήσεις στην αξιολόγηση των κυτταρικών και γονιδιακών θεραπειών. Η πρώτη και μεγαλύτερη πρόκληση είναι το άμεσο και εμπροσθοβαρές κόστος που έχουν αυτές και το οποίο δεν είναι συμβατό με τα τρέχοντα μοντέλα αποζημίωσης. Το κόστος στην πάροδο του χρόνου εξελίσσεται μικρότερο από αυτό που έχουν οι μακροχρόνιες θεραπείες. Ετσι, οι μηχανισμοί των συστημάτων αποζημίωσης θα πρέπει να εξελιχθούν για να μπορούν έγκαιρα να υποστηρίζουν την εισαγωγή αυτών των θεραπειών και να δίνουν πρόσβαση στους ασθενείς.
Οπως τόνισε, μία γονιδιακή κυτταρική θεραπεία έχει όφελος για μία ολόκληρη ζωή. Δεν είναι δυνατόν λοιπόν μέσα από μία κλινική μελέτη που αφορά συγκεκριμένο αριθμό ασθενών και συγκεκριμένη χρονική περίοδο να μπορέσει να αποδειχθεί αυτό το μακροχρόνιο όφελος. Αυτό είναι πολύ σημαντικό να το καταλάβουν οι οργανισμοί οι οποίοι σκέφτονται με τον παραδοσιακό τρόπο της αξιολόγησης των συμβατικών θεραπειών.
Οι οργανισμοί αποζημίωσης, κατά τον κ. Χ. Δάκα, εστιάζουν πολύ στο κόστος που υπάρχει λόγω της χορήγησης μιας φοράς αντί να βλέπουν την ανάγκη που υπάρχει για τη θεραπεία αυτή αλλά και για το μακροχρόνιο αποτέλεσμα.
Ποια είναι τα μοντέλα αποζημίωσης για την υποδοχή τέτοιων θεραπειών
Υπάρχουν νεωτεριστικά μοντέλα που μπορούν να δώσουν απαντήσεις στους προβληματισμούς για προσιτές τιμές και στην αβεβαιότητα για το όφελος που αυτές έχουν.
Ενα τέτοιο μοντέλο είναι των δόσεων σε βάθος χρόνου. Για παράδειγμα, το κόστος μπορεί να διαμοιραστεί σε βάθος μιας πενταετίας.
Τι αλλαγές πρέπει να γίνουν για να υπάρχει εύκολη πρόσβαση των ασθενών σε αυτές
Η κοινωνία έχει πολύ υψηλές προσδοκίες από τις κυτταρικές και γονιδιακές θεραπείες. Το πιστεύω του είναι ότι θα δώσουν πολύ μεγαλύτερη αποτελεσματικότητα από αυτή που έχουμε γνωρίσει, θα είναι προσαρμοσμένη και σχεδιασμένη και υπάρχει όφελος πολλών ετών. Επίσης οι αρχές θα πρέπει να δείχνουν μεγαλύτερη αποδοχή αλλά και ελαστικότητα στα στοιχεία που προσπαθούν να δουν σχετικά με την αποτελεσματικότητα και το κλινικό όφελος αυτών των θεραπειών.
Πρέπει λοιπόν να υπάρχει μια μεγαλύτερη ευθυγράμμιση με τις εγκρίσεις των μηχανισμών του εξωτερικού, όπως είναι ο ΕΜΑ και ο FDA, oι οποίοι έχουν προχωρήσει πάρα πολύ σε σχέση με αυτό που γίνεται αυτή τη στιγμή με τις Επιτροπές Αξιολόγησης και Αποζημίωσης στα Ευρωπαϊκά κράτη.
Ολοκληρώνοντας, τα δεδομένα της καθημερινής κλινικής πρακτικής πρέπει να γίνονται αποδεκτά για να δώσουν απαντήσεις στις εγκριτικές επιτροπές και στις επιτροπές αποζημίωσης. Μέσα λοιπόν στα REal World Evidence που πρέπει να λαμβάνονται υπόψη για την αποτελεσματικότητα και το όφελος των κυτταρικών και γονιδιακών θεραπειών να παίρνουμε τα στοιχεία που προέρχονται από τα registries και τις μελέτες παρατήρησης και επίσης πρέπει να υπάρχει ένα μοίρασμα του φορτίου ανάμεσα σε όλους τους stakeholders.
Διδάκτωρ Φαρμακευτικής Χημείας του University of Wales - Cardiff. Με 30ετή προϋπηρεσία στο χώρο του φαρμάκου, με εμπειρία σε ηγετικές θέσεις στους τομείς της βιοτεχνολογίας και των σπανίων παθήσεων.
Σήμερα είναι Executive Director - Country Manager, υπεύθυνος για Ελλάδα, Κύπρο και Μάλτα για της Νovartis Gene Therapies, μίας εταιρείας του ομίλου Novartis, που ειδικεύεται στις γονιδιακές θεραπείες για σπάνια νευρομυϊκά νοσήματα, ενώ έχει διατελέσει για σειρά ετών Διευθύνων Σύμβουλος της Shire Pharmaceuticals.
Πρώην αντιπρόεδρος του Συνδέσμου Φαρμακευτικών Επιχειρήσεων Ελλάδος (ΣΦΕΕ) και του PhRMA Innovation Forum (PIF).
Ειδήσεις υγείας σήμερα
Ο νυχτερινός θόρυβος του κυκλοφοριακού επηρεάζει την καρδιομεταβολική υγεία [μελέτη]
Πώς επηρεάζουν τα αυγά την υγεία της καρδιάς
Θεμιστοκλέους: Δεν αποκλείεται νέα κορύφωση γρίπης εάν υποχωρήσει η θερμοκρασία
 Ολοκληρώνεται το "σπίτι" των κυτταρικών και γονιδιακών θεραπειών - Πότε θα λειτουργήσει
Ολοκληρώνεται το "σπίτι" των κυτταρικών και γονιδιακών θεραπειών - Πότε θα λειτουργήσει 'Eτοιμο σε 4 μήνες
'Eτοιμο σε 4 μήνες Τα υπάρχοντα συστήματα αποζημίωσης δεν ευνοούν τις κυτταρικές και γονιδιακές θεραπείες
Τα υπάρχοντα συστήματα αποζημίωσης δεν ευνοούν τις κυτταρικές και γονιδιακές θεραπείες Healthcare Transformation - Αντ. Καρόκης: Η πρόκληση των γονιδιακών και κυτταρικών θεραπειών [βίντεο]
Healthcare Transformation - Αντ. Καρόκης: Η πρόκληση των γονιδιακών και κυτταρικών θεραπειών [βίντεο] siREN: Χρυσό μετάλλιο στη θεραπευτική πρόταση του ΑΠΘ για τη χρόνια λεμφοκυτταρική λευχαιμία
siREN: Χρυσό μετάλλιο στη θεραπευτική πρόταση του ΑΠΘ για τη χρόνια λεμφοκυτταρική λευχαιμία 'Αδ. Γεωργιάδης: Την άνοιξη του 2026 το Κέντρο Κυτταρικών και Γονιδιακών Θεραπειών
'Αδ. Γεωργιάδης: Την άνοιξη του 2026 το Κέντρο Κυτταρικών και Γονιδιακών Θεραπειών Πώς επηρεάζουν τα αυγά την υγεία της καρδιάς
Πώς επηρεάζουν τα αυγά την υγεία της καρδιάς ΕΟΔΥ: 15 νέοι θάνατοι ασθενών με γρίπη, 7 με CoViD και σημαντική αύξηση RSV
ΕΟΔΥ: 15 νέοι θάνατοι ασθενών με γρίπη, 7 με CoViD και σημαντική αύξηση RSV ΦΣΘ: Ποιοι ασθενείς μπορούν να παίρνουν ΦΥΚ από φαρμακεία της γειτονιάς - Η διαδικασία
ΦΣΘ: Ποιοι ασθενείς μπορούν να παίρνουν ΦΥΚ από φαρμακεία της γειτονιάς - Η διαδικασία Ενέσεις αδυνατίσματος: Ο σοβαρός κίνδυνος από τη μακροχρόνια χρήση
Ενέσεις αδυνατίσματος: Ο σοβαρός κίνδυνος από τη μακροχρόνια χρήση Κομοτηνή: "Εμφύλιος" Ιατρικού Συλλόγου - νοσοκομείου για τους ιδιώτες γιατρούς
Κομοτηνή: "Εμφύλιος" Ιατρικού Συλλόγου - νοσοκομείου για τους ιδιώτες γιατρούς Οι 43 δραστικές ουσίες των ΦΥΚ που παρέχονται από ιδιωτικά φαρμακεία [κατάλογος]
Οι 43 δραστικές ουσίες των ΦΥΚ που παρέχονται από ιδιωτικά φαρμακεία [κατάλογος] RSV: 4,5 φορές πάνω η θετικότητα τον Ιανουάριο - 4η στην Ευρώπη η Ελλάδα [πίνακας]
RSV: 4,5 φορές πάνω η θετικότητα τον Ιανουάριο - 4η στην Ευρώπη η Ελλάδα [πίνακας] Εγκεφαλικό επεισόδιο: Σημαντική δευτερογενής πρόληψη με νέα θεραπεία
Εγκεφαλικό επεισόδιο: Σημαντική δευτερογενής πρόληψη με νέα θεραπεία Φάρμακα για την πίεση και ροφήματα που τα επηρεάζουν
Φάρμακα για την πίεση και ροφήματα που τα επηρεάζουν 7 ογκολογικά φάρμακα πέρασαν από ταχεία έγκριση
7 ογκολογικά φάρμακα πέρασαν από ταχεία έγκριση Δώρα Χρυσικού: "Δεν θα πω ποτέ ότι ο καρκίνος ήταν δάσκαλος"
Δώρα Χρυσικού: "Δεν θα πω ποτέ ότι ο καρκίνος ήταν δάσκαλος" "Αγλαΐα Κυριακού": Κοριτσάκι 30 ημερών στη ΜΕΘ με RSV - Ποια είναι τα συμπτώματα
"Αγλαΐα Κυριακού": Κοριτσάκι 30 ημερών στη ΜΕΘ με RSV - Ποια είναι τα συμπτώματα