Η Υπηρεσία Τροφίμων και Φαρμάκων ενέκρινε το φάρμακο της AstraZeneca, (anifrolumab) για τη θεραπεία του ερυθηματώδους λύκου, καθιστώντας το αντίσωμα το πρώτο νέο σκεύασμα που εγκρίθηκε για την αυτοάνοση νόσο, 10 χρόνια μετά από τότε που η GlaxoSmithKline έλαβε έγκριση για το Belimumab, το 2011.
Το anifrolumab έχει σχεδιαστεί για να μπλοκάρει την πρωτεΐνη ενεργοποίησης του ανοσοποιητικού που ονομάζεται ιντερφερόνη τύπου 1.
Η έγκριση ήρθε παρά το γεγονός ότι το σκεύασμα απέτυχε σε μία από τις δύο βασικές δοκιμές του που είχαν ως στόχο να δείξουν ότι η θεραπεία θα μπορούσε να μειώσει τη δραστηριότητα της νόσου και τη βλάβη των οργάνων στους ασθενείς. Ο FDA συχνά απαιτεί από τα φάρμακα να έχουν δύο επιτυχημένες δοκιμές πριν χορηγήσει την τελική έγκριση για ένα φάρμακο.
Οι ομάδες υπεράσπισης ασθενών υποστήριξαν την απόφαση του FDA, η οποία έρχεται έξι μήνες αφότου ο οργανισμός εκχώρησε σε ένα άλλο φάρμακο, στο voclosporin της Aurinia Pharmaceuticals το πράσινο φως, για τη θεραπεία ενός είδους νεφρικής νόσου που προκαλείται από τον λύκο.
Η Consultants Global Data προέβλεψε ότι παγκόσμιες πωλήσεις των φαρμάκων για την θεραπεία του λύκου θα φτάσουν το 1,6 δισ. δολ. έως το 2028, σημειώνοντας ετήσια άνοδο κατά 6% ετησίως. Στο μεταξύ, πολλά φάρμακα βρίσκονται σε εξέλιξη για τη θεραπεία του λύκου, συμπεριλαμβανομένων του baricitinib της Eli Lilly, του obinutuzumab της Roche και του πειραματικού σκευάσματος dapirolizumab από την UCB.
Η AstraZeneca δεν ανακοίνωσε πότε θα κυκλοφορήσει το anifrolumab ούτε την τιμή του.
Η GlaxoSmithKline χρέωνε περίπου 28.000 δολάρια ανά ασθενή για το Belimumab,, αν και αυτό το ποσό δεν περιλαμβάνει τις εκπτώσεις από την φαρμακοβιομηχανία.
Πηγές:
biopharmadive
Ειδήσεις υγείας σήμερα
Χειρουργήθηκε στο ΚΑΤ μετά από ατύχημα η Μαρέβα Γκραμπόφσκι - Μητσοτάκη
Πώς θα προλάβουμε την υπέρταση
Πώς να ξεκινήσω να ακολουθώ μεσογειακή διατροφή

 Η γήρανση πιθανόν αμβλύνει τα συμπτώματα ερυθηματώδους λύκου [μελέτη]
Η γήρανση πιθανόν αμβλύνει τα συμπτώματα ερυθηματώδους λύκου [μελέτη]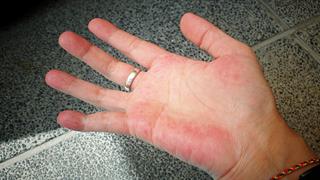 Συστηματικός ερυθηματώδης λύκος: Γιατί τα συμπτώματα εξασθενούν με την ηλικία
Συστηματικός ερυθηματώδης λύκος: Γιατί τα συμπτώματα εξασθενούν με την ηλικία 7ο Πανελλήνιο Συνέδριο ΡευΜΑζήν: Καινοτομία και μέλλον στην αντιμετώπιση των ρευματικών νοσημάτων
7ο Πανελλήνιο Συνέδριο ΡευΜΑζήν: Καινοτομία και μέλλον στην αντιμετώπιση των ρευματικών νοσημάτων 10 Μαΐου: Παγκόσμια Ημέρα κατά του Συστηματικού Ερυθηματώθη Λύκου- ''Κάντε τον Λύκο αναγνωρίσιμο''
10 Μαΐου: Παγκόσμια Ημέρα κατά του Συστηματικού Ερυθηματώθη Λύκου- ''Κάντε τον Λύκο αναγνωρίσιμο'' Λύκος, η νόσος με τα πολλά πρόσωπα - Αιτία, αντιμετώπιση, νέες θεραπείες
Λύκος, η νόσος με τα πολλά πρόσωπα - Αιτία, αντιμετώπιση, νέες θεραπείες Πώς η διατροφή επηρεάζει τα συμπτώματα του λύκου
Πώς η διατροφή επηρεάζει τα συμπτώματα του λύκου Πώς θα προλάβουμε την υπέρταση
Πώς θα προλάβουμε την υπέρταση Πώς να ξεκινήσω να ακολουθώ μεσογειακή διατροφή
Πώς να ξεκινήσω να ακολουθώ μεσογειακή διατροφή Σπανάκι: Ωμό ή μαγειρεμένο;
Σπανάκι: Ωμό ή μαγειρεμένο; Χειρουργήθηκε στο ΚΑΤ μετά από ατύχημα η Μαρέβα Γκραμπόφσκι - Μητσοτάκη
Χειρουργήθηκε στο ΚΑΤ μετά από ατύχημα η Μαρέβα Γκραμπόφσκι - Μητσοτάκη Κομοτηνή: "Εμφύλιος" Ιατρικού Συλλόγου - νοσοκομείου για τους ιδιώτες γιατρούς
Κομοτηνή: "Εμφύλιος" Ιατρικού Συλλόγου - νοσοκομείου για τους ιδιώτες γιατρούς Πώς να απαλλαγείτε οριστικά από το κότσι: Οι συμβουλές του ειδικού
Πώς να απαλλαγείτε οριστικά από το κότσι: Οι συμβουλές του ειδικού Οι 43 δραστικές ουσίες των ΦΥΚ που παρέχονται από ιδιωτικά φαρμακεία [κατάλογος]
Οι 43 δραστικές ουσίες των ΦΥΚ που παρέχονται από ιδιωτικά φαρμακεία [κατάλογος] Σημάδια κατάθλιψης στις γυναίκες
Σημάδια κατάθλιψης στις γυναίκες Χίος: Οι γιατροί του νοσοκομείου για την πολύνεκρη τραγωδία
Χίος: Οι γιατροί του νοσοκομείου για την πολύνεκρη τραγωδία Απεβίωσε ο ομότιμος καθηγητής Καρδιολογίας Γιώργος Παρχαρίδης
Απεβίωσε ο ομότιμος καθηγητής Καρδιολογίας Γιώργος Παρχαρίδης Πρωτόκολλα, κόφτες, "Προλαμβάνω" ροκάνισαν το clawback στην Πρωτοβάθμια Φροντίδα
Πρωτόκολλα, κόφτες, "Προλαμβάνω" ροκάνισαν το clawback στην Πρωτοβάθμια Φροντίδα Πώς να ενισχύσουμε φυσικά τον μεταβολισμό μας
Πώς να ενισχύσουμε φυσικά τον μεταβολισμό μας